domingo, 2 de septiembre de 2018
semana 28
EN ESTA SEMANA SE HACEN LAS DECORACIONES DE LA ANTIOQUEÑIDAD Y SE CELEBRA FOTOS DE LA ANTIOQUIÑIDAD 2018 COMPARTIDAS POR ALI
semana 26
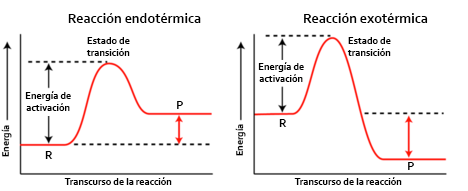
Reacciones quimicas organicas:
en las reacciones organicas generalmente ocurren dos o mas etapas en las cuales se forman unas sustancias intermedias entre los negativos y el producto final
sustrato:es la sustancia que sera atacada por el reactivo y hace parte de el producto principal
reactivo:en la qca organica generalmete hay 3 tipos de reactivos que son:
-electrofilos
-nucleofilos
radicales libres
clasificacion de reacciones organicas:
se clasifican en polares y apolares
polares:
-reacciones de sustitucion o desplazamiento
-reaccion de adicion
en las reacciones organicas generalmente ocurren dos o mas etapas en las cuales se forman unas sustancias intermedias entre los negativos y el producto final
sustrato:es la sustancia que sera atacada por el reactivo y hace parte de el producto principal
reactivo:en la qca organica generalmete hay 3 tipos de reactivos que son:
-electrofilos
-nucleofilos
radicales libres
clasificacion de reacciones organicas:
se clasifican en polares y apolares
polares:
-reacciones de sustitucion o desplazamiento
-reaccion de adicion
-reaccioreanes de eliminacion
-reacciones de reagrupacion
-reacciones de oxidacion
-reacciones de acido-base
no polares:
-reacciones de sustitucion o desplazamiento
-reacciones de adicion
-reacciones de eliminacion
-reacciones de reagrupacion
-reacciones de reagrupacion
-reacciones de oxidacion
-reacciones de acido-base
no polares:
-reacciones de sustitucion o desplazamiento
-reacciones de adicion
-reacciones de eliminacion
-reacciones de reagrupacion

semana 25
zReacciones organicas
son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
laboratorio:
tema: Reconocimientos de algunos grupos funcionales y propiedades fiicas de compuestos organicos
logros:
*reconocer experimentalmente aldehidos y cetonas, accidos carboxilicos y obtener acetileno
*reconocer las porpiedades fisicas de algunos compuestos organicos
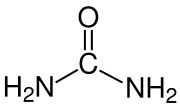
urea
naftaleno-naflalina

acetato de plomo

acido citrico

acido benzoico
formol
son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas. En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
laboratorio:
tema: Reconocimientos de algunos grupos funcionales y propiedades fiicas de compuestos organicos
logros:
*reconocer experimentalmente aldehidos y cetonas, accidos carboxilicos y obtener acetileno
*reconocer las porpiedades fisicas de algunos compuestos organicos
urea

naftaleno-naflalina
acetato de plomo
acido citrico

acido benzoico
formol
semana 24
La proyección de Fischer
Proyectar consiste en dibujar en dos dimensiones (plano) una
molécula. En la proyección de Fischer la molécula se dibuja en forma de
cruz con los sustituyentes que van al fondo del plano en la vertical y
los grupos que salen hacia nosotros en la horizontal, el punto
intersección de ambas líneas representa el carbono proyectado.
Aunque se acostumbra a dejar la cadena carbonada en la vertical,
puede girarse la molécula de diferentes formas dando lugar a
proyecciones de Fischer aparentemente diferentes, pero que en realidad
representan la misma molécula.
Para comprobar que la proyección está bien hecha, vamos a dar notación R/S a la molécula y a su proyección.

Para comprobar que la proyección está bien hecha, vamos a dar notación R/S a la molécula y a su proyección.
Ahora haremos la proyección de una molécula con dos centros quirales

Para proyectar una molécula en Fischer es necesario dibujarla en la conformación eclipasada. Los sustituyentes que nos quedan en el plano van colocados arriba y abajo en la proyección. Los grupos que salen hacia nosotros (cuñas) se disponen a la derecha en la proyección, y los que van al fondo (lineas a trazos) se disponen a la izquierda.
Para proyectar una molécula en Fischer es necesario dibujarla en la conformación eclipasada. Los sustituyentes que nos quedan en el plano van colocados arriba y abajo en la proyección. Los grupos que salen hacia nosotros (cuñas) se disponen a la derecha en la proyección, y los que van al fondo (lineas a trazos) se disponen a la izquierda.
semana 23
isomeria geometrica:
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono. Esta
restricción puede ser debida a la presencia de dobles enlaces o ciclos.
Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y
trans. El isómero que tiene los hidrógenos al mismo lado se llama cis, y
el que los tiene a lados opuestos trans.
Los compuestos cíclicos, debido a su rigidez, también presentan
isomería geométrica. Así, el 1,2-dimetilciclohexano puede existir en
forma de dos isómeros. Se llama isómero cis el que tiene los hidrógenos
al mismo lado y trans el que los tiene a lados opuestos.

Sin embargo, si hay cuatro grupos diferentes unidos a un átomo de carbono, la situación es distinta. Vemos cómo una estructura de este tipo (2a) tiene una estructura imagen especular (2b) que no es superponible con ella; es decir, no hay manera de girar la estructura 2b en el espacio tal que consiga superponerla a la 2a. A este respecto las estructuras 2a y 2b son similares a las manos derecha e izquierda. Estas estructuras, imágenes especulares no superponibles, se llaman enantiómeros. Siempre que un átomo de carbono tiene cuatro átomos o grupos distintos unidos a él, son posibles dos estructuras enantiómeras, y por ello existirán dos estereoisómeros.
semana 22
Isomeria conformacional:
En química orgánica, los isómeros conformacionales o confórmeros son estereoisómeros que se caracterizan por poder interconvertirse (modificar su orientación espacial, convirtiéndose en otro isómero de la misma molécula) a temperatura ambiente, por rotación en torno a enlaces simples. Estas conformaciones se denominan: anti, eclipsada o alternada. Son compuestos que, generalmente, no pueden aislarse físicamente, debido a su facilidad de interconversión.
En química orgánica, los isómeros conformacionales o confórmeros son estereoisómeros que se caracterizan por poder interconvertirse (modificar su orientación espacial, convirtiéndose en otro isómero de la misma molécula) a temperatura ambiente, por rotación en torno a enlaces simples. Estas conformaciones se denominan: anti, eclipsada o alternada. Son compuestos que, generalmente, no pueden aislarse físicamente, debido a su facilidad de interconversión.
nota:se realiza un quiz preguntado y formando la formulacion de una estructura de :
-funsion
-posicion
-cadena
semana 21
Isomeria estructural:
es una forma de isomeria en la que las moléculas con la misma fórmula molecular tienen diferentes patrones de unión y organización atómica, en oposición a estereoisomerismo , en el que los enlaces moleculares están siempre en el mismo orden y solo el arreglo espacial difiere. Hay sinónimos múltiples para isómeros constitucionales.Tres categorías de isómeros constitucionales son los isómeros esqueléticos, posicionales y funcionales. Los isómeros posicionales también se llaman regioisómeros.
isomeria de cadena:
Se llaman isómeros a aquellas moléculas que poseen la misma fórmula molecular pero diferenteestructura. Se clasifican en isómeros estructurales y estereoisómeros. Los isómeros estructurales difieren en la forma de unir los átomos y a su vez se clasifican en isómeros de cadena de posición y de función
Isomería de posición
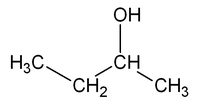
La presentan aquellos compuestos que poseen el mismo esqueleto carbonado pero en los que el grupo funcional ocupa diferente posición.Por ejemplo, la fórmula molecular C4H10O puede corresponder a dos sustancias isómeras que se diferencian en la posición del grupo OH: el 1-butanol y el 2-butanol.
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| 1-butanol, Butan-1-ol o n-butanol | 2-butanol, Butan-2-ol o sec-butanol |
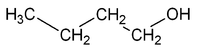
|
|
Isomería funcional
Varía el grupo funcional, conservando el esqueleto carbonado.Por ejemplo el C3H6O puede corresponder a la molécula de propanal (función aldehído) o a la propanona (función cetona).
| CH3-CH2-CHO | CH3-CO-CH3. | |
|---|---|---|
| Propanal (función aldehído) | Propanona (función cetona) |
Esta isomería la presentan ciertos grupos de compuestos relacionados como: los alcoholes y éteres, los ácidos y ésteres, y también los aldehídos y cetonas.
Tautomería
Artículo principal: Tautómero
Es un tipo especial de isomería en la que existe transposición de un
átomo entre las dos estructuras, generalmente hidrógeno, existiendo
además un fácil equilibrio entre ambas formas tautómeras.Un ejemplo de la misma es la tautomería ceto-enólica en la que existe equilibrio entre un compuesto con grupo OH unido a uno de los átomos de carbono de un doble enlace C=C, y un compuesto con el grupo carbonilo intermedio, C=O típico de las cetonas, con transposición de un átomo de hidrógeno.
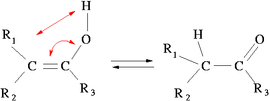
|
|---|
| Tautomería ceto-enólica. |
isomeria espacial:
moleculares
idénticas y sus átomos presentan la misma distribución (la misma forma
de la cadena; los mismos grupos funcionales y sustituyentes; situados en
la misma posición), pero su disposición en el espacio es distinta. Los
isómeros tienen igual forma en el plano. Es necesario representarlos en
el espacio para visualizar las diferencias. Puede ser de dos tipos:
isomería conformacional e isomería configuracional, según que los
isómeros se puedan convertir uno en otro por simple rotación de enlaces
simples, o no.
semana 20
Comiensa el tercer periodo
Isomeria:
Compuestos organicos:
-son muy abundantes
-la mayoria poseen enlaces covalentes
-la mayoria son solubles e insolubles en h2O
-son de origen vegetal o animal
-la mayoria son combustibles
Compuestos inorganicos:
-hay muy pocos
-la mayoria poseen enlaces tonicos
-la mayoria son solubles en H2O e insolubles en organicos
-la mayorria no son combustibles
Suscribirse a:
Entradas (Atom)





















